PXT3003: Novità da Pharnext su potenziale trattamento della CMT

Durante l’R&D Day Virtual Event, svoltosi il 13 ottobre 2020, Pharnext, azienda che sta sviluppando il PXT3003 (nome commerciale papabile: Singility) come potenziale trattamento della CMT o Charcot-Marie-Tooth, ha presentato le ultime novità in merito ai propri piani per lo sviluppo di questa molecola e come procederà l’ultima parte dello studio clinico di fase III, necessario per l’approvazione del farmaco se l’efficacia fosse dimostrata.
La CMT o Charcot-Marie-Tooth è una malattia neuromuscolare che colpisce i nervi periferici, impedendo o rendendo difficoltosi i movimenti di mani e gambe. Tra i sintomi tipici, deformità, disturbi dell’equilibrio e del cammino, inciampi e cadute frequenti. Non esiste una cura ad oggi, il trattamento è prevalentemente sintomatico, ricorrendo alla fisioterapia per rallentare la progressione della malattia e/o alla chirurgia per correggere eventuali deformità e migliorare il cammino.
Negli ultimi anni, diverse aziende farmaceutiche, tra cui la francese Pharnext, hanno portato avanti dei programmi di sviluppo clinico di molecole che potrebbero avere una potenziale azione benefica per i pazienti con CMT.
Novità da Pharnext su PXT3003, potenziale trattamento della CMT
Dopo i problemi legati alla formulazione del principio attivo nella prima fase 3, la società ha subito un profondo cambiamento dell’assetto e delle figure al vertice, con l’ingresso del dott. David Horn Solomon (CEO), del dott. Adrian Hepner (CMO) e di Peter Collum (CFBO).
Durante l’evento, il dott. Mario Saporta dell’Università di Miami ha presentato un quadro della CMT1A, forma di Charcot-Marie-Tooth per la quale il PXT3003 è stato progettato; a seguire, Allison Moore, CEO dell’associazione american Hereditary Neuropathy Foundation, ha parlato delle difficoltà che la convivenza con la CMT comporta e dell’enorme impatto che questa malattia neuromuscolare ha nella vita quotidiana dei pazienti.
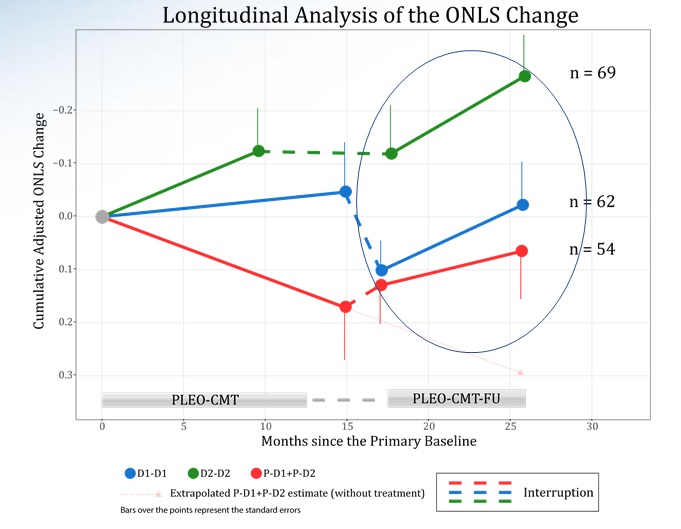
Infine, il dott. Adrian Hepner ha presentato una panoramica del progetto di sviluppo del PXT3003, combinazione di tre principi a basso dosaggio, dalla nascita del potenziale farmaco al suo stato attuale e gli sviluppi previsti. Nel precedente studio, interrotto per le suddette problematiche, è stato registrato un significativo miglioramento dell’ONLS (scala di valutazione della gravità di malati neurologici) in tutti i gruppi, incluso quello dei pazienti che non avevano inizialmente assunto il farmaco. Sospendendo l’assunzione tra studio e follow-up, questa tendenza al miglioramento peggiora, ma riprende quando i pazienti tornano ad assumere il farmaco. Non è ancora noto se il miglioramento di questo indice si traduca in un miglioramento percepibile della salute e della qualità di vita dei pazienti con Charcot-Marie-Tooth.
Il nuovo studio di Fase III del PXT3003
L’azienda ha dichiarato che il nuovo studio, necessario all’immissione in commercio qualora il farmaco si dimostrasse efficace e i risultati convincano gli enti regolatori, prenderà il via nel primo trimestre del 2021 in Europa e America. Saranno previsti solo due gruppi, placebo e dose alta, la formulazione del farmaco sarà a dose liquida singola, più semplice da assumere (per l’immissione in commercio, è prevista una formulazione in capsule).
Lo studio avrà una durata di 15 mesi, pertanto verosimilmente i risultati verranno elaborati e diffusi nella seconda metà del 2022. Si ipotizza che lo studio pediatrico per verificare l’efficacia di questo cocktail di farmaci nei bambini prenderà il via al termine dello studio negli adulti.
Le diapositive presentate durante l’evento (in inglese) sono scaricabili da questo link. Come Associazione, ribadiamo l’atteggiamento prudente già espresso nei confronti di questa sperimentazione e attendiamo di conoscere i risultati completi al termine di questa nuova fase dello studio.
Aggiornamento del 1/2/2021 sul nuovo trial PXT3003
Con un comunicato stampa, l’azienda ha fatto sapere che inizierà il trattamento del primo paziente del nuovo studio di fase III entro il 31 marzo. Si prevede che lo studio, denominato PREMIER, condotto su pazienti con CMT1A da lieve a moderata, arruolerà circa 350 soggetti da 50 centri in tutto il mondo. La FDA ha stabilito che gli studi cardine richiesti per la presentazione della richiesta di un nuovo farmaco includono lo studio PREMIER e uno studio fattoriale di combinazione preclinica in un modello animale di CMT1A ben convalidato. Lo studio coinvolgerà anche il nostro paese, con 4/5 centri coinvolti.
Pharnext sta inoltre continuando a condurre il suo studio di estensione di fase III in corso, CLN-PXT3003-03, uno studio in aperto che coinvolge 187 pazienti con forme di CMT1A da lievi a moderate su 323 pazienti arruolati nel primo studio di fase III in doppio cieco (PLEO-CMT). Ad oggi, 130 pazienti CMT1A sono ancora trattati con PXT3003 ad alte dosi e sono stati seguiti per più di 2 anni al fine di valutare non solo la sicurezza e la tollerabilità di PXT3003, ma anche l’efficacia a lungo termine. Pharnext riporterà i dati provvisori sulla sicurezza e l’efficacia di PXT3003 raccolti finora da questo studio in aperto durante il secondo trimestre del 2021.
Centri coinvolti nello studio clinico di fase III “Premier” per la CMT
 Attraverso il portale americano che elenca i dettagli dello studio “Premier” con il cocktail di farmaci per la CMT denominato PXT3003, apprendiamo che i centri coinvolti per l’Italia (non per tutti è già attivo il reclutamento) saranno 5:
Attraverso il portale americano che elenca i dettagli dello studio “Premier” con il cocktail di farmaci per la CMT denominato PXT3003, apprendiamo che i centri coinvolti per l’Italia (non per tutti è già attivo il reclutamento) saranno 5:
- Azienda Ospedaliera Universitaria San Martino, Università Degli Studi di Genova – Clinica Neurologica
Contatto: Marta Traversa, 0103537065, dinogtrials2@unige.it; Referente: Marina Grandis - Azienda Ospedaliera Universitaria, Policlinico “G. Martino” di Messina
Contatto e Referente: Anna Mazzeo, 09022117309, annamazzeo@yahoo.it ; - Università di Roma Tor Vergata
Contatto: Erica Frezza, 3921017782, frz.erica@gmail.com; Referente: Roberto Massa - Ospedale Policlinico G.B. Rossi – Neurologia, Verona
Contatto e Referente: Gian Maria Fabrizi, 0458126021, gianmaria.fabrizi@univr.it - Università di Napoli Federico II
Contatto: Stefano Tozza, 0817464579, ste.tozza@gmail.com; Referente: Fiore Manganelli
Per poter partecipare allo studio, è necessario rispettare i seguenti criteri di inclusione:
- Età: 16-65 anni
- Diagnosi di CMT1A (lo studio, almeno in questa fase, è limitato alla forma più comune)
- Non aver partecipato o essere convivente con chi ha partecipato in passato ad altri studi con il PXT3003
- Non avere una gravidanza in corso
- Non avere una ipersensibilità o intolleranza a uno dei tre farmaci (Naltrexone, Baclofen o Sorbitolo) del PXT3003
