I risultati del trial PREMIER di Pharnext per PXT3003

Attraverso due comunicati stampa, Pharnext ha reso note le analisi preliminari dei risultati dello studio clinico PREMIER sul cocktail di farmaci PXT3003, proviamo a fare chiarezza su quanto emerso
Pharnext, una società biofarmaceutica francese che sta sviluppando terapie innovative per malattie neurodegenerative che non hanno attualmente trattamenti, l’11 dicembre 2023 ha annunciato con un comunicato stampa i risultati principali del suo cruciale studio clinico di Fase III (trial PREMIER) su PXT3003, il suo candidato farmaco nella malattia di Charcot-Marie-Tooth di tipo 1A (CMT1A), una rara neuropatia periferica debilitante.
I risultati della nuova fase 3
Inaspettatamente, la Overall Neuropathy Limitation Scale (ONLS, scala di misurazione della limitazione globale delle neuropatie), che misura l’invalidità motoria funzionale, non ha confermato i risultati del precedente trial clinico, interrotto per problemi di formulazione. I pazienti con CMT1A lieve-moderata hanno mostrato un miglioramento sia con il trattamento che con il placebo, invece del lento peggioramento tipico della progressione naturale della CMT1A. Questo miglioramento inaspettato nel gruppo placebo complica l’interpretazione dei risultati basati su questo parametro, che era stato scelto come criterio primario di valutazione dell’efficacia che però potrebbe essere rilevante nel lungo termine, ma non in un periodo così breve come uno studio clinico. Una delle principali sfide nell’analisi dei risultati è la lenta progressione della CMT1A e la natura soggettiva di alcune valutazioni cliniche, che possono essere influenzate dagli effetti del placebo e della riabilitazione. Ciò rende difficile determinare l’impatto e l’effettiva efficacia del trattamento.
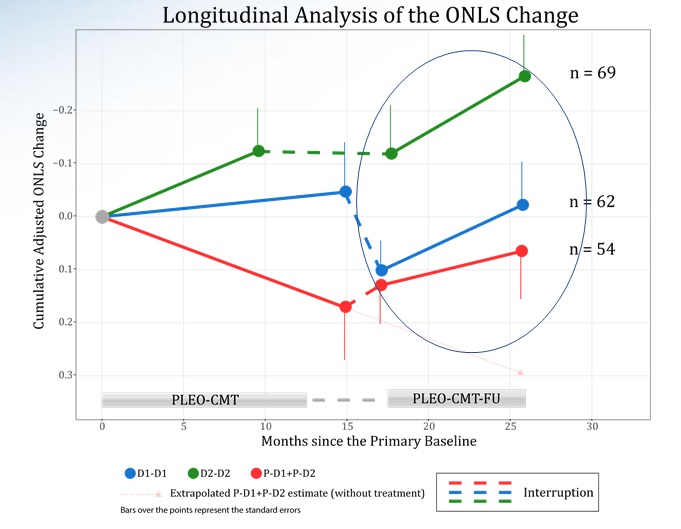
Andamento dell’ONLS nel precedente trial clinico PLEO-CMT
Nel frattempo, altri dati dello studio suggeriscono l’assenza di peggioramento delle condizioni cliniche dei pazienti sotto trattamento, il che è un segno positivo nel contesto di una malattia degenerativa come la CMT1A. Questo suggerisce che PXT3003 potrebbe stabilizzare la condizione dei pazienti, cosa importante per una malattia in cui la progressione è generalmente inevitabile.
Inoltre, lo studio ha confermato l’alto profilo di sicurezza del trattamento, già stabilito in studi precedenti. Questo profilo di sicurezza è cruciale per i trattamenti di malattie croniche come la CMT1A.
Considerando questi risultati iniziali, Pharnext prevede di continuare ad analizzare i dati nel corso del I trimestre del 2024, razionalizzando quanto emerso e attendendo i risultati di uno studio clinico gemello in Cina, dove i diritti di commercializzazione sono stati acquisiti dalla società Tasly.
Nuovi risultati da una nuova valutazione dei dati
In successivo comunicato, datato 19 dicembre 2023, Pharnext ha reso nota la sua intenzione di procedere con la richiesta di commercializzazione del loro candidato farmaco PXT3003 in Europa (EMA) e Stati Uniti d’America (FDA), sfruttando tutti i dati in loro possesso per avvalorare l’ipotesi che PXT3003 abbia un effetto benefico per le persone con CMT1A.
Mentre le analisi primarie confermano i risultati principali della fase III ottenuti sulla Overall Neuropathy Limitation Scale (ONLS) e sul Charcot-Marie-Tooth Neuropathy Score versione 2 (CMTNS-v2), che non mostrano differenze significative nella risposta clinica tra trattamento e placebo, ulteriori analisi prespecificate dei sottogruppi suggeriscono un segnale di efficacia. Infatti, nell’analisi dei sottogruppi di pazienti, è stata osservata una migliore risposta nei pazienti relativamente magri e giovani, con un BMI (indice di massa corporea) <25, suggerendo un dosaggio insufficiente per le persone con un peso corporeo maggiore, o nei pazienti sotto i 45 anni.
Inoltre, l’analisi dei dati ha rivelato che, sebbene lo studio nel suo complesso fosse randomizzato, in doppio cieco, a due bracci con controllo placebo, ciascuno dei centri partecipanti allo studio clinico non è stato bilanciato tra i due gruppi. Di conseguenza, in alcuni centri, i pazienti hanno ricevuto solo il placebo e in altri solo il trattamento; questo potrebbe aver creato un pregiudizio nei ricercatori chiamati a misurare l’efficacia del trattamento, alterando la valutazione. A riprova di ciò, quando vengono esclusi i dati provenienti dai centri con meno di due pazienti per gruppo placebo/trattato, esiste una differenza statisticamente significativa tra i gruppi trattati e placebo sul punteggio ottenuto con la scala di valutazione CMTNS-v2.
La richiesta di commercializzazione di PXT3003 di Pharnext
Da tutti questi nuovi risultati, dai risultati dello studio di fase II, dal primo studio di fase III e dagli studi di estensione, uno dei quali ha superato i 6 anni, dal notevole profilo di sicurezza del prodotto e dall’assenza di qualsiasi trattamento approvato o in fase clinica avanzata per CMT1A, Pharnext ritiene che possa esserci la possibilità di concordare un percorso di registrazione per PXT3003 per il trattamento della CMT1A, con FDA e EMA, gli enti regolatori di Stati Uniti e Europa, rispettivamente.
Da qui in avanti, il team si concentrerà nel mettere in prospettiva tutti i dati accumulati in oltre dieci anni, in parallelo con la letteratura medica che descrive la storia naturale di CMT1A. Questa analisi consentirà al Consiglio di Sorveglianza e alla Direzione della Società di decidere se avviare un incontro con la FDA o attendere i risultati dello studio di fase III attualmente in corso in Cina da parte del partner Tasly, che ha acquisito i diritti di licenza per PXT3003 in Cina nel 2017.
 Hugo Brugière, Manager di Pharnext, ha dichiarato: “Sono lieto di poter confermare oggi quanto detto l’11 dicembre: rimaniamo fiduciosi di poter finalmente portare una soluzione medica ai pazienti senza alcun trattamento. Lo studio approfondito dei dati clinici rivela maggiori dettagli sulle possibili affermazioni per il nostro candidato farmaco e non contraddice i risultati degli studi precedenti. Questo è un segnale incoraggiante per il futuro, che permette al Consiglio di Sorveglianza, alla Direzione, agli opinion-leader e ai nostri partner di continuare a progredire”
Hugo Brugière, Manager di Pharnext, ha dichiarato: “Sono lieto di poter confermare oggi quanto detto l’11 dicembre: rimaniamo fiduciosi di poter finalmente portare una soluzione medica ai pazienti senza alcun trattamento. Lo studio approfondito dei dati clinici rivela maggiori dettagli sulle possibili affermazioni per il nostro candidato farmaco e non contraddice i risultati degli studi precedenti. Questo è un segnale incoraggiante per il futuro, che permette al Consiglio di Sorveglianza, alla Direzione, agli opinion-leader e ai nostri partner di continuare a progredire”
Le impressioni dei pazienti e di ACMT-Rete
La notizia del mancato raggiungimento del risultato primario dello studio clinico, ovvero un miglioramento del punteggio dell’ONLS rispetto al placebo, è stata per la community internazionale di persone con CMT e per le associazioni una doccia fredda.
Questi nuovi risultati e le analisi dei dati che seguiranno per razionalizzare questo esito inaspettato, uniti a un atteggiamento molto collaborativo e trasparente dell’azienda con la quale siamo costantemente in contatto, fanno ben sperare che, se l’azienda riuscirà a produrre delle prove robuste dell’efficacia del trattamento, questi possa arrivare sul mercato ed essere commercializzato. Ricordiamo che al momento non esiste alcun trattamento farmacologico della Charcot-Marie-Tooth in generale e della CMT1A, in particolare.
Ribadiamo il nostro atteggiamento prudente nei confronti di qualunque sperimentazione clinica e ci uniamo in un grandissimo grazie a tutti partecipanti agli studi clinici, che mettono il loro tempo per le visite di valutazione e, potenzialmente, la loro salute a disposizione e a beneficio di tutti i pazienti ❤️

